Lista de genes para análisis basados en ADN
AAK1, ABCB1, ABCG2, ABL1, ABL2, ABRAXAS1, ACD, ACVR1, ADGRA2, ADRB1, ADRB2, AIP, AIRE, AJUBA, AKT1, AKT2, AKT3, ALK, ALOX12B, AMER1, ANKRD26, APC, APLNR, APOBEC3A, APOBEC3B, AR, ARAF, ARHGAP35, ARID1A, ARID1B, ARID2, ARID5B, ASXL1, ASXL2, ATM, ATP1A1, ATR, ATRX, AURKA, AURKB, AURKC, AXIN1, AXIN2, AXL, B2M, BAP1, BARD1, BAX, BCHE, BCL10, BCL11A, BCL11B, BCL2, BCL3, BCL6, BCL9, BCL9L, BCOR, BCORL1, BCR, BIRC2, BIRC3, BIRC5, BLM, BMI1, BMPR1A, BRAF, BRCA1, BRCA2, BRD3, BRD4, BRD7, BRIP1, BTK, BUB1B, CALR, CAMK2G, CARD11, CASP8, CBFB, CBL, CBLB, CBLC, CCDC6, CCND1, CCND2, CCND3, CCNE1, CD274, CD79A, CD79B, CD82, CDC73, CDH1, CDH11, CDH2, CDH5, CDK1, CDK12, CDK4, CDK5, CDK6, CDK8, CDKN1A, CDKN1B, CDKN1C, CDKN2A, CDKN2B, CDKN2C, CEBPA, CENPA, CEP57, CFTR, CHD1, CHD2, CHD4, CHEK1, CHEK2, CIC, CIITA, CKS1B, CNKSR1, COL1A1, COMT, COQ2, CREB1, CREBBP, CRKL,CRLF2, CRTC1, CRTC2, CSF1R, CSF3R, CSMD1, CSNK1A1, CTCF, CTLA4, CTNNA1, CTNNB1, CTRC, CUX1, CXCR4, CYLD, CYP1A2, CYP2A7, CYP2B6, CYP2C19, CYP2C8, CYP2C9, CYP2D6, CYP3A4, CYP3A4, DAXX, DCC, DDB2, DDR1, DDR2, DDX11, DDX3X, DDX41, DEK, DHFR, DICER1, DIS3L2, DNMT1, DNMT3A, DOT1L, DPYD, E2F3, EBP, EED, EFL1, EGFR, EGLN1, EGLN2, EIF1AX, ELAC2, ELF3, EME1, EML4, EMSY, EP300, EPAS1, EPCAM, EPHA2, EPHA3, EPHA4, EPHB4, EPHB6, ERBB2, ERBB3, ERBB4, ERCC1, ERCC2, ERCC3, ERCC4, ERCC5, ERG, ERRFI1, ESR1, ESR2, ETNK1, ETS1, ETV1, ETV4, ETV5, ETV6, EWSR1, EXO1, EXT1, EXT2, EZH1, EZH2, FAN1, FANCA, FANCB, FANCC, FANCD2, FANCE, FANCF, FANCG, FANCI, FANCL, FANCM, FAS, FAT1, FBXO11, FBXW7, FEN1, FES, FGF10, FGF14, FGF19, FGF2, FGF23, FGF3, FGF4, FGF5, FGF6, FGF9, FGFBP1, FGFR1, FGFR2, FGFR3, FGFR4, FH, FLCN, FLI1, FLT1, FLT3, FLT4, FOXA1, FOXA2, FOXE1, FOXL2,FOXO1, FOXO3, FOXP1, FOXQ1, FRK, FRS2, FUBP1, FUS, FYN, G6PD, GALNT12, GATA1, GATA2, GATA3, GATA4, GATA6, GGT1, GLI1, GLI2, GLI3, GNA11, GNA13, GNAQ, GNAS, GNB3, GPC3, GPER1, GREM1, GRIN2A, GRM3, GSK3A, GSK3B, GSTP1, H3-3A, H3-3B, H3C2, HABP2, HCK, HDAC1, HDAC2, HDAC6, HGF, HIF1A, HLA-A, HLA-B, HLA- C, HLA-DPA1, HLA-DPB1, HLA-DQA1, HLA-DQB1, HLA-DRA, HLA-DRB1, HMGA2, HMGCR, HMGN1, HNF1A, HNF1B, HOXB13, HRAS, HSD3B1, HSP90AA1, HSP90AB1, HTR2A, ID3, IDH1, IDH2, IDO1, IFNGR1, IFNGR2, IGF1R, IGF2, IGF2R, IKBKB, IKBKE, IKZF1, IKZF3, IL1B, IL1RN, ING4, INPP4A, INPP4B, INPPL1, INSR, IRF1, IRF2, IRS1, IRS2, IRS4, ITPA, JAK1, JAK2, JAK3, JUN, KAT6A, KDM5A, KDM5C, KDM6A, KDR, KEAP1, KIAA1549, KIF1B, KIT, KLF2, KLF4, KLHL6, KLLN, KMT2A, KMT2B, KMT2C, KMT2D, KNSTRN, KRAS, KSR1, LATS1, LATS2, LCK, LIG4, LIMK2, LRP1B, LRRK2, LTK, LYN, LZTR1, MAD2L2, MAF, MAGI1,MAGI2, MAML1, MAP2K1, MAP2K2, MAP2K3, MAP2K4, MAP2K5, MAP2K6, MAP2K7, MAP3K1, MAP3K13, MAP3K14, MAP3K3, MAP3K4, MAP3K6, MAP3K8, MAPK1, MAPK11, MAPK12, MAPK14, MAPK3, MAX, MBD1, MC1R, MCL1, MDC1, MDH2, MDM2, MDM4, MECOM, MED12, MEF2B, MEN1, MERTK, MET, MGA, MGMT, MITF, MLH1, MLH3, MLLT10, MLLT3, MN1, MPL, MRE11, MS4A1, MSH2, MSH3, MSH4, MSH5, MSH6, MSR1, MST1R, MTAP, MTHFR, MTOR, MT-RNR1, MTRR, MUC1, MUTYH, MXI1, MYB, MYC, MYCL, MYCN, MYD88, MYH11, MYH9, NAT2, NBN, NCOA1, NCOA3, NCOR1, NF1, NF2, NFE2L2, NFKB1, NFKB2, NFKBIA, NFKBIE, NIN, NKX2-1, NLRC5, NOTCH1, NOTCH2, NOTCH3, NOTCH4, NPM1, NQO1, NR1I3, NRAS, NRG1, NRG2, NSD1, NSD2, NSD3, NT5C2, NT5E, NTHL1, NTRK1, NTRK2, NTRK3, NUMA1, NUP98, NUTM1, OPRM1, PAK1, PAK3, PAK4, PAK5, PALB2, PALLD, PARP1, PARP2, PARP4, PAX3, PAX5, PAX7, PBK, PBRM1, PBX1, PDCD1, PDCD1LG2, PDGFA, PDGFB, PDGFC, PDGFD,PDGFRA, PDGFRB, PDIA3, PDK1, PDPK1, PGR, PHF6, PHOX2B, PIGA, PIK3C2A, PIK3C2B, PIK3C2G, PIK3CA, PIK3CB, PIK3CD, PIK3CG, PIK3R1, PIK3R2, PIK3R3, PIM1, PKHD1, PLCG1, PLCG2, PLK1, PML, PMS1, PMS2, POLD1, POLE, POLH, POLQ, POT1, PPM1D, PPP2R1A, PPP2R2A, PRDM1, PREX2, PRKAR1A, PRKCA, PRKCI, PRKD1, PRKDC, PRKN, PRMT5, PRSS1, PSMB1, PSMB10, PSMB2, PSMB5, PSMB8, PSMB9, PSMC3IP, PSME1, PSME2, PSME3, PSPH, PTCH1, PTCH2, PTEN, PTGS2, PTK2, PTK6, PTK7, PTPN11, PTPN12, PTPRC, PTPRD, PTPRS, PTPRT, RABL3, RAC1, RAC2, RAD21, RAD50, RAD51, RAD51B, RAD51C, RAD51D, RAD54B, RAD54L, RAF1, RALGDS, RARA, RASA1, RASAL1, RB1, RBM10, RECQL4, RET, RFC2, RFWD3, RFX5, RFXANK, RFXAP, RHBDF2, RHEB, RHOA, RICTOR, RINT1, RIPK1, RIT1, RNASEL, RNF43, ROS1, RPS20, RPS6KB1, RPS6KB2, RPTOR, RSF1, RUNX1, RYR1, SAMHD1, SAV1, SBDS, SCG5, SDHA, SDHAF2, SDHB, SDHC, SDHD, SEC23B, SERPINB9,SETBP1, SETD2, SETDB1, SF3B1, SGK1, SH2B1, SH2B3, SHH, SIK2, SIN3A, SKP2, SLC19A1, SLC26A3, SLCO1B1, SLIT2, SLX4, SMAD3, SMAD4, SMARCA4, SMARCB1, SMARCD1, SMARCE1, SMC1A, SMC3, SMO, SOCS1, SOX11, SOX2, SOX9, SPEN, SPINK1, SPOP, SPRED1, SPTA1, SRC, SRD5A2, SRGAP1, SRSF2, SSTR1, SSTR2, SSX1, STAG1, STAG2, STAT1, STAT3, STAT5A, STAT5B, STK11, SUFU, SUZ12, SYK, TAF1, TAF15, TAP1, TAP2, TAPBP, TBK1, TBL1XR1, TBX3, TCF3, TCF4, TCF7L2, TCL1A, TEK, TENT5C, TERC, TERF2IP, TERT, TET1, TET2, TFE3, TGFB1, TGFBR2, TLR4, TLX1, TMEM127, TMPRSS2, TNFAIP3, TNFRSF11A, TNFRSF13B, TNFRSF14, TNFRSF8, TNFSF11, TNK2, TOP1, TOP2A, TP53, TP53BP1, TP63, TPMT, TPX2, TRAF2, TRAF3, TRAF5, TRAF6, TRAF7, TRRAP, TSC1, TSC2, TSHR, TTK, TUBB, TYMS, U2AF1, UBE2T, UBR5, UGT1A1, UGT2B15, UGT2B7, UIMC1, UNG, USP34, USP9X, VEGFA, VEGFB, VHL, VKORC1, WRN, WT1, XIAP, XPA, XPC, XPO1,XRCC1, XRCC2, XRCC3, XRCC5, XRCC6, YAP1, YES1, ZFHX3, ZNF217, ZNF703, ZNRF3, ZRSR2
Detección basada en ADN de fusiones seleccionadas en estos genes
ALK, BCL2, BCR, BRAF, BRD4, EGFR, ERG, ETV4, ETV6, EWSR1, FGFR1, FGFR2, FGFR3, FUS, MET, MYB, MYC, NOTCH2, NTRK1, PAX3, PDGFB, RAF1, RARA, RET, ROS1, SSX1… SUZ12… TAF15… TCF3… TFE3… TMPRSS2
Opción de análisis de transcripción de fusión basada en ARN (Estudio realizado bajo pedido)
Lista de genes para la detección de fusión de novo:
ABL1, AFAP1, AGK, AKAP12, AKAP4, AKAP9, AKT2, AKT3, ALK, ASPSCR1, BAG4, BCL2, BCORL1, BCR, BICC1, BRAF, BRD3, BRD4, CCAR2, CCDC6, CD74, CIC, CLTC, CNTRL, COL1A1, CRTC1, DDIT3, EGFR, EML4, ERBB2, ERBB4, ERG, ESR1, ETV1, ETV4, ETV5, ETV6, EWSR1, EZR, FGFR1, FGFR2, FGFR3, FLI1, FN1, FUS, GOPC, JAZF1, KIAA1549, KIF5B, MAGI3, MAML1, MET, MGA, MYB, MYC, NAB2, NCOA4, NFIB, NOTCH2, NPM1, NRG1, NSD3, NTRK1, NTRK2, NTRK3, NUTM1, PAX3, PAX7, PAX8, PDGFB, PDGFRB, PIK3CA, PLAG1, PML, POU5F1, PRKAR1A, QKI, RAF1, RARA, RET, ROS1, SDC4, SHTN1, SLC34A2, SND1, SQSTM1, SS18, SSX1, STAT6, STRN, SUZ12, TACC1, TACC3, TAF15, TFE3, TFG, THADA, TMPRSS2, TPM3, TPR, TRIM24, TRIM33, WT1, YAP1, ZMYM2, ZNF703
Lista de genes para puntos de ruptura seleccionados en estos genes de fusión:
TRIM24-BRAF, KIAA1549-BRAF, SND1-BRAF, EML4-ALK, CLTC-ALK, NPM1-ALK, TPM3-ALK, KIF5B-ALK, ETV6-NTRK3, EWSR1-ERG, EWSR1-FLI1, FGFR3-TACC3, FGFR2- BICC1, FGFR2-TACC3, FGFR1-TACC1, TMPRSS2-ERG, TPM3-NTRK1, TPR-NTRK1, TRIM24-NTRK2, AFAP1-NTRK2, QKI-NTRK2, ETV6NTRK2, KIF5B-RET, CCDC6-RET, NCOA4-RET, PRKAR1A-RET, TRIM33-RET, CD74-ROS1, EZR-ROS1, SLC34A2ROS1, TPM3-ROS1, SDC4-ROS1, BRD4-NUTM1, BRD3-NUTM1, MAG-NUTM1, NSD3-NUTM1, NAB2-STAT6
Lista de variantes de transcripción específicas:
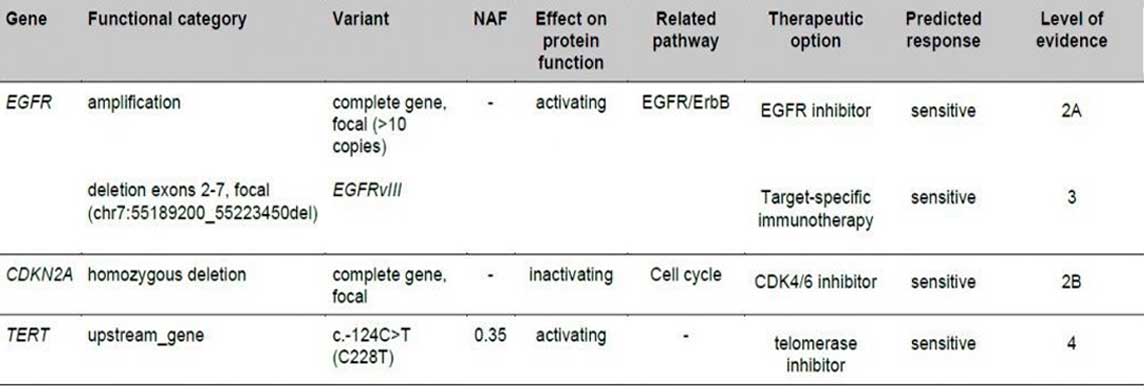
EGFR del ex25-26, EGFR del ex25-27 , EGFR VII, EGFR VIII, MET ex14